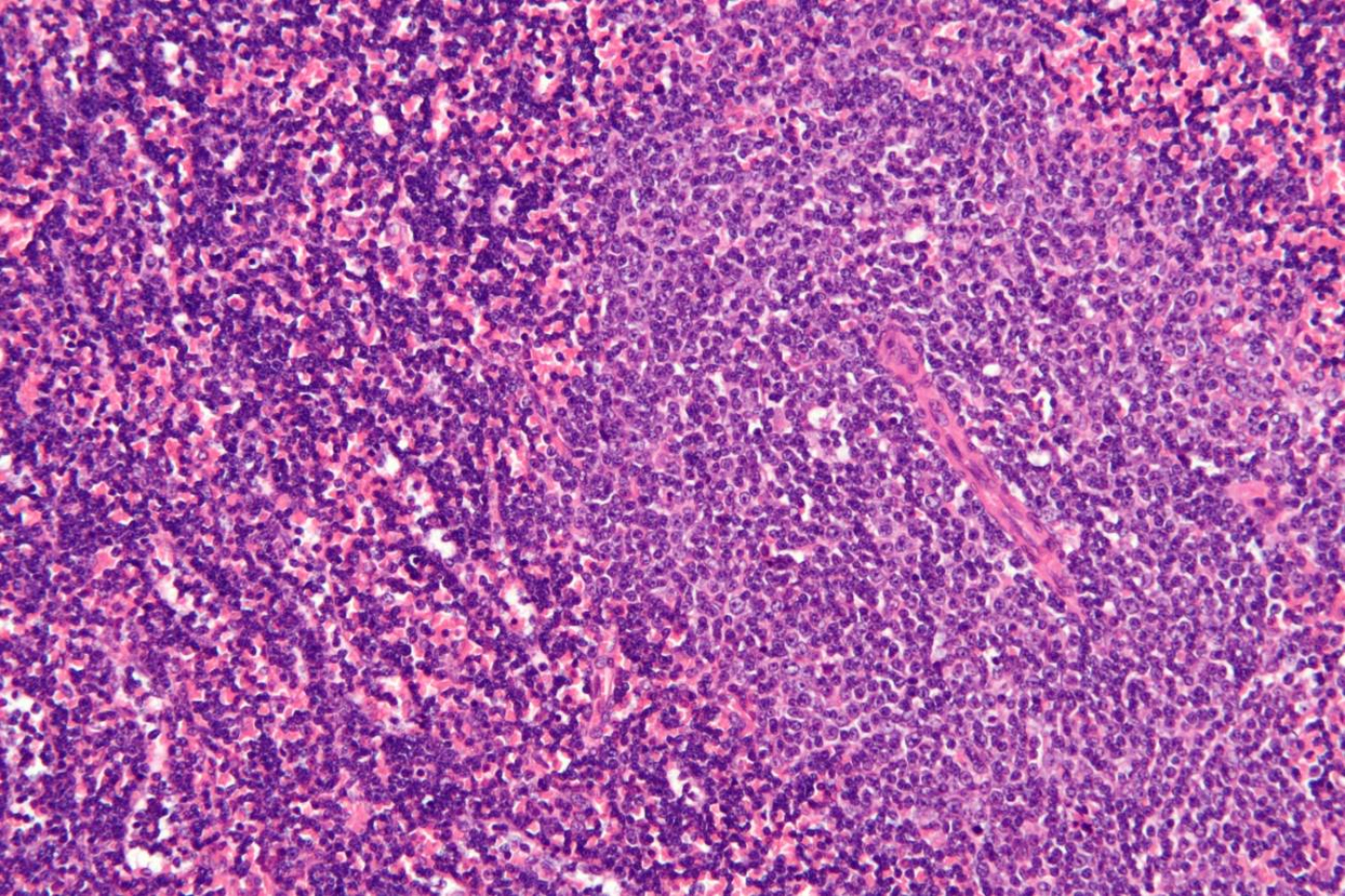
El hallazgo, publicado en la revista Molecular Cancer, muestra que más del 82 % de los pacientes con este cáncer –que se origina en un tipo de glóbulos blancos (los linfocitos) en la médula ósea y puede extenderse a la sangre– expresan niveles altos del gen RRAS2 y que las cantidades más altas del mismo se relacionan con leucemias más agresivas.
“Este hecho, junto con la identificación de un marcador en el gen, nos permite plantear que la mayor parte de las leucemias linfocíticas crónicas en humanos están causadas por la sobreexpresión de RRAS2”, explica el director del estudio, Balbino Alarcón, del Centro de Biología Molecular Severo Ochoa (CSIC-UAM).
Gracias a este descubrimiento, el gen RRAS2 se perfila como un marcador inequívoco en la detección de la leucemia linfocítica crónica y abre las puertas a la exploración de nuevos tratamientos. “Creemos que la proteína codificada por este gen puede ser un blanco importante para la generación de nuevos fármacos eficaces en el tratamiento de esta enfermedad”, asegura el experto.
Un oncogén sin mutaciones
Los cánceres aparecen por la acumulación de daños en los genes de las células del organismo. La búsqueda de genes concretos como responsables de distintos tipos de tumores, los oncogenes, se desarrolla mediante la identificación de mutaciones.
Estas provocan cambios en la secuencia de aminoácidos de las proteínas codificadas por estos genes. Sin embargo, en este nuevo estudio se ha descubierto que RRAS2 causa leucemia linfocítica crónica sin mutaciones en su secuencia de aminoácidos.
La relevancia de este dato radica en las formas de detección, pues el marcador de la posible presencia de cáncer no se basa en la mutación, sino en la propia cantidad del gen en el organismo. “Hemos observado que la expresión en cantidades por encima de lo normal del gen RRAS2 sin mutaciones en ratones es suficiente para provocar la aparición de leucemia linfocítica crónica en todos los animales”, concluye Alarcón.
Agencia SINC