Las personas diabéticas pueden recuperar la capacidad de producir insulina mediante el trasplante de células beta aisladas del páncreas de donantes de órganos. Sin embargo, este tratamiento es complejo y poco habitual, ya que se necesitan al menos dos donantes para tratar a una persona.
Durante mucho tiempo se ha intentado producir células beta funcionales a partir de células madre para usarlas en los trasplantes, lo que poco a poco está haciendo posible que este tratamiento se convierta en realidad.
No obstante, las células beta producidas a partir de células madre hasta ahora han sido inmaduras, ya que no regulaban bien la secreción de insulina. Esto explicaría por qué algunos de los ensayos clínicos de estos tratamientos con células inmaduras que se han llevado a cabo en EE UU no hayan logrado grandes avances.
Un paso más en el tratamiento de la diabetes
Un equipo de investigación encabezado por Timo Otonkoski en la Universidad de Helsinki, y llevado a cabo en colaboración con el investigador posdoctoral Diego Balboa en el Centro de Regulación Genómica (CRG), ha llevado a cabo esfuerzos pioneros para optimizar la funcionalidad de las células pancreáticas producidas a partir de células madre.
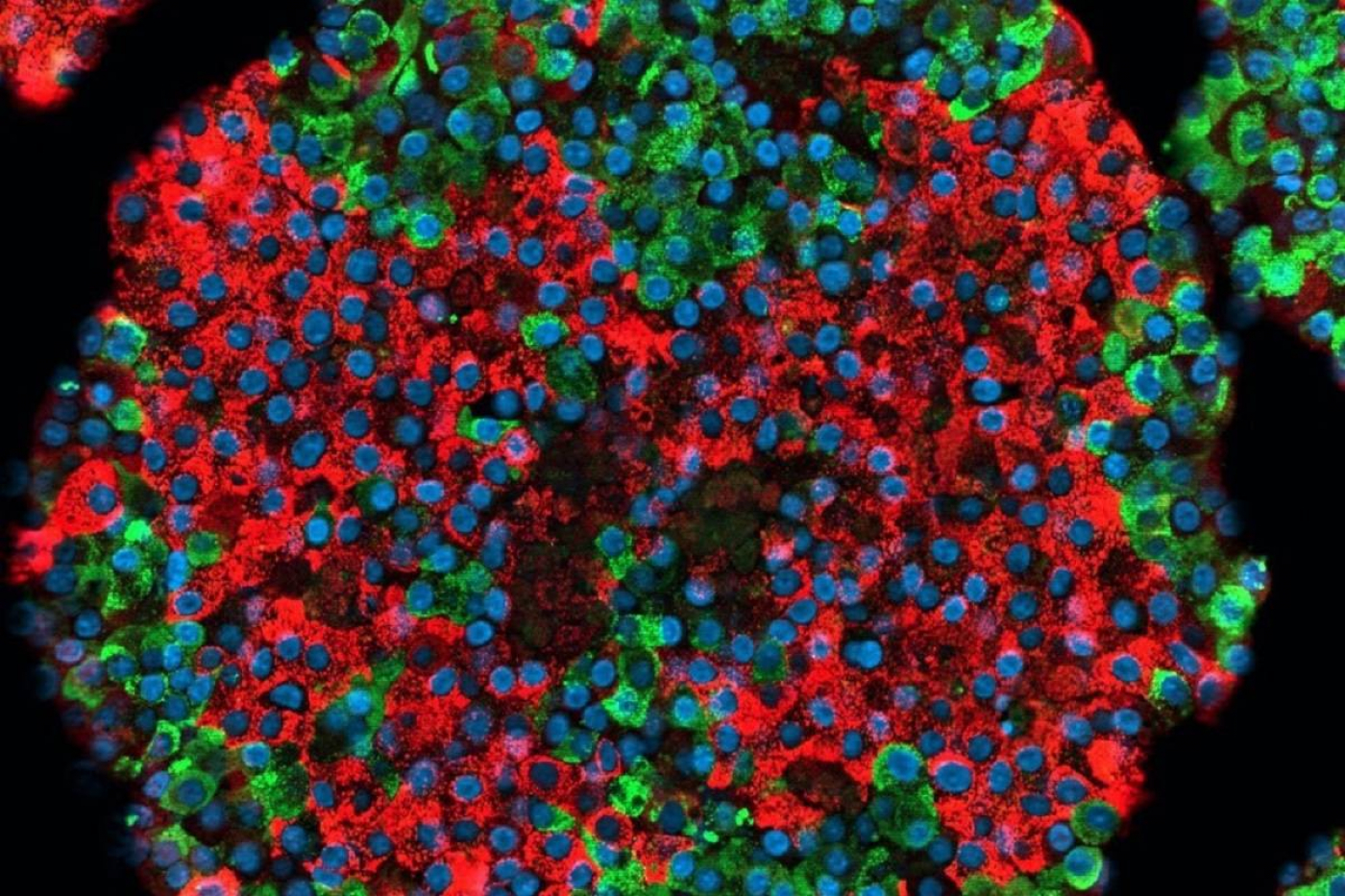
En un artículo publicado hoy en Nature Biotechnology el grupo ha demostrado, por primera vez, que las células madre pueden formar otras que se parecen mucho a los islotes pancreáticos normales, tanto en términos de estructura como de función.
“La secreción de insulina se regula de manera adecuada en las células, y que estas responden a los cambios en el nivel de glucosa incluso mejor que los islotes pancreáticos aislados de donantes de órganos que se usaron como controles”, afirma Väinö Lithovius, miembro del grupo de la Universidad de Helsinki.
“Nuestro estudio es un avance importante para transformar las células madre y convertirlas en piezas de repuesto para reemplazar las células beta del páncreas destruidas o estropeadas, que son las causantes de la diabetes. Aunque queda trabajo por hacer, esto nos acerca un paso más al tratamiento de personas diabéticas con células beta derivadas de células madre, algo que ya no pertenece al ámbito de la ciencia ficción”, indica Balboa.
El estudio más completo hasta la fecha
El equipo científico demostró la función de estas células tanto en cultivos celulares como en estudios con ratones. En los roedores, los investigadores demostraron que las células beta derivadas de células madre trasplantadas comenzaron a controlar de manera efectiva el metabolismo de la glucosa.
“Los niveles de glucosa en sangre son más altos en ratones que en humanos, aproximadamente entre 8 y 10 milimolares. Después del trasplante de células, el nivel disminuyó al que se había observado en humanos, aproximadamente de 4 a 5 milimolares. Se mantuvo en este nivel, lo que demuestra que el trasplante derivado de células madre era capaz de regular a largo plazo los niveles de glucosa en sangre en estos animales”, señala Jonna Saarimäki-Vire, responsable del trasplante de células y también investigadora de la Universidad de Helsinki.
El estudio de la función de las células beta publicado hoy es el más completo en el campo hasta la fecha. Además de la secreción de insulina, el equipo investigó la funcionalidad de los sistemas que regulan la secreción de insulina, incluidos el metabolismo y los canales iónicos, y también conectaron los hallazgos con la expresión génica en las células individuales.
Según Balboa, los islotes derivados de células madre también son útiles para estudiar los mecanismos de la patología que subyace la diabetes, trabajo que sigue desarrollando en el CRG: “Podemos generar millones de estas células en el laboratorio y hacer preguntas sobre qué defectos en los genes y la maquinaria celular hacen que las células fallen, lo que nos ayuda a desentrañar las causas moleculares precisas de la diabetes y a identificar nuevas dianas terapéuticas. También usamos las células para explorar los efectos de nuevos medicamentos para tratar la diabetes”.
“Nuestro trabajo ayudará a mejorar aún más la producción de islotes de células madre, lo que facilitará su uso en modelos de enfermedades y terapias celulares”, concluye Otonkoski.
Agencia SINC